Methodenbeschreibung Zi COVID-19-Projektion
Dr. Lars Eric Kroll, Dr. Edgar Steiger, Dr. Mandy Schulz
Stand
Diese Datei hat den Stand: 20.05.2020.
Zusammenfassung
Wir haben auf Basis der aktuellen verfügbaren Fallzahlen für Deutschland, der aktuellen Bevölkerung sowie der Intensiv-Bettenzahl (ICU) in Deutschland, die für die Versorgung von COVID-19-Patienten zur Verfügung steht, die Zahl der inzidenten und prävalenten Patienten fortgeschrieben und abgeschätzt, wie sich diese Entwicklung auf den ambulanten und stationären Leistungsbedarf auswirkt.
Methoden
Projektion der inzidenten Fälle
Die Entwicklung der inzidenten Fälle wurde empirisch auf Basis der Fallzahlentwicklung der bisherigen Entwicklung geschätzt. Hier war die einzig eingehende Annahme die Dauer der Infektion, diese wurde mit 14 Tagen pro Patient angesetzt. Das RKI modelliert mit 10 Tagen Infektionsdauer (Heiden und Buchholz 2020), geht dafür aber vom angesetzten Erkrankungsbeginn statt Meldedatum aus. Vor Erkrankungsbeginn sind mehrere Tage Inkubationszeit anzusetzen, ebenso entstehen Probleme durch eventuelle Nachmeldungen. Zur Modellierung der Infektionsentwicklung wurde zunächst eine Schätzung der zeitlich variierenden Reproduktionszahl durchgeführt (Thompson u. a. 2019) und anschließend ein SIR-Modell für die Projektion verwendet (Kermack und McKendrick 1991). Die zeitlich variierende Reproduktionszahl \(R_t\) beschreibt die Dynamik der Übertragbarkeit einer Infektion während einer Epidemie (als Erweiterung der Basis-Reproduktionszahl \(R_0\), die für eine bestimmte Infektion konstant ist und die Übertragbarkeit nur zu Beginn der Epidemie beschreibt). Das SIR-Modell ist ein klassisches Modell der mathematischen Epidemiologie zur dynamischen Modellierung von Infektionskrankheiten. Die Bevölkerung wird in drei Gruppen aufgeteilt: \(S\) (“susceptibles”, nicht Infizierte), \(I\) (“infectious”, infiziert & ansteckend), sowie \(R\) (“removed”, Genesene und Gestorbene, nicht mehr ansteckend). Auf der Basis von gemeldeten historischen Daten (für Deutschland: Robert Koch-Institut “RKI”, https://corona.rki.de/, international: Johns Hopkins University “JHU”, https://coronavirus.jhu.edu/) und einer angenommenen Verweildauer im Status \(I\) sowie den berechneten \(R_t\) können damit Modellierungen über die Größe der drei Gruppen durchgeführt werden.
Drei Szenarien für die weitere Entwicklung der inzidenten Fälle
International und national zeigt sich, dass Maßnahmen zur Eindämmung der Übertragung Erfolg haben. Wir haben darum in unseren Szenarien die Effekte der aktuellen Maßnahmen in Deutschland mit einbezogen. Weiterhin lässt sich die beobachtete Entwicklung der zeitlich variierenden Reproduktionszahl \(R_t\) als Trend fortschreiben.
Szenario 1 “Trend lokal”
In Szenario 1 (“Trend lokal”) berechnen wir für jeden Landkreis, jedes Bundesland, Gesamtdeutschland sowie auch internationale Vergleichsländer einen eigenen Trend aus den lokalen historischen Daten. Dies bedeutet, dass wir die vergangene Entwicklung der zeitlich variierenden Reproduktionszahl \(R_t\) berücksichtigen und projizieren auf dieser Basis die zukünftige Entwicklung von \(R_t\) und damit der Fallzahlen. Ist das derzeitige \(R_t\) größer als \(0{,}7\), wird der Trend bis zu diesem Wert fortgeschrieben und danach konstant gehalten. Sollte \(R_t\) derzeit bereits kleiner als \(0{,}7\) sein, wird es konstant auf dem derzeitigen Niveau gehalten, da dies bereits ein sehr günstiges Szenario darstellt.
Szenario 2 “Trend Bund”
In Szenario 2 (“Trend Bund”) nehmen wir den “lokalen Trend” von Gesamtdeutschland und setzen diesen als Maßstab insbesondere für die Landkreise an. Da in den Landkreisen die Fallzahlen deutlich kleiner sind als auf höheren Aggregationsebenen, können die Parameterschätzungen des lokalen Trends instabil sein, sodass die Verwendung des bundesdeutschen Trends sinnvoller erscheint. Für Landkreise mit derzeit ungünstiger Entwicklung bedeutet die Anwendung des bundesdeutschen Trends eventuell ein “Best Case”-Szenario, da sich die Ansteckungsrate in Deutschland derzeit sehr positiv darstellt.
Szenario 3 “Worst Case \(R_t\)=1,3”
In Szenario 3 modellieren wir ein “Worst Case”-Szenario, bei dem die derzeitige Reproduktionszahl \(R_t\) innerhalb von 7 Tagen ein Niveau von \(1{,}3\) anstrebt und dann dort verharrt. Dies bedeutet ein erneutes exponentielles Wachstum der Fallzahlen. Wir versuchen damit die schwer abschätzbaren Folgen einer zu umfassenden Lockerung der Eindämmungsmaßnahmen zu modellieren.
Projektion des stationären Behandlungsbedarfs
Eingehende Annahmen der Modellierung im Hinblick auf die stationäre Versorgung betreffen den Anteil der Intensiv-Betten in Deutschland sowie den Anteil der Patienten, die intensivmedizinisch versorgt werden müssen. Wir gehen in unserer Projektion davon aus, dass ca. 6% der inzidenten Patienten eine ICU-Versorgung benötigen, auf Basis internationaler Zahlen aus China und Südkorea könnte der Anteil allerdings auch höher sein: Anhand der Daten von 1.099 Patienten mit bestätigter COVID-19-Infektion aus 552 Krankenhäusern in China berichten Guan u. a. (2020) eine Einweisungsrate in eine Intensive Care Unit (ICU) von 5,0% und von einer Beatmungsrate 2,3%. China CDC Weekly berichtet von 14% schweren Fällen, die eine Hospitalisierung und Beatmung erforderlich machen sowie ebenfalls von einer ICU-Einweisungsrate von 5% (The NCPERE Team 2020). Verity u. a. (2020) berichten eine ähnliche Rate von 13,8% Hospitalisierung und 6,1% ICU-Einweisungen. Demgegenüber steht der Report aus der Lombardei in Italien, wo innerhalb der ersten 2 Wochen ICU-Einweisungsraten zwischen 12% (relativ zu allen bestätigten Fällen) und 16% (relativ zu allen hospitalisierten Fällen) beobachtet wurden (Grasselli u. a. 2020). Hier besteht also derzeit eine gewisse Unsicherheit in der Modellierung. Die für die Versorgung von COVID-19-Patienten potentiell zur Verfügung stehende Bettenzahl wird seit 16. April 2020 verpflichtend von den Krankenhäusern an die Deutsche interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI) gemeldet (Intensivregister, https://www.intensivregister.de/). Wir gehen von 25% der gemeldeten Kapazität aus, da auch weiterhin andere Intensivfälle behandelt werden müssen.
In unseren Modellierungen berücksichtigen wir eine Rate von 13,8% Hospitalisierungen, sowie davon 50% ICU-Notwendigkeit (analog zu WHO Team (2020) und Verity u. a. (2020)). Darüber hinaus gehen wir von einer Liegezeit von 15 Tagen in der ICU-Versorgung aus (DGEpi 2020), wobei die Hospitalisierung 6 Tage und die ICU-Notwendigkeit sich nach weiteren 2 Tagen nach der Infektion ergibt (Heiden und Buchholz 2020).
Daten und Projektion des ambulanten Behandlungsbedarfs
Für den ambulanten Behandlungsbedarf von COVID-19 durch Vertragsärzte sind insbesondere die Dauer und die Anzahl der erkrankten Patienten relevant. Die Betreuung der Patienten wird sicher in ihrem Umfang variieren, wir setzen hier lediglich Durchschnittswerte für den Behandlungsaufwand von drei Patientengruppen an.
In der Modellgruppe \(I\) sind dies einerseits Patienten mit niedrigem Behandlungsbedarf (infiziert und symptomatisch, etwa 56,5 Prozent der Infizierten), die in unserem Modell etwa 5 Minuten pro Konsultation alle 2 Tage benötigen, andererseits Patienten mit erhöhtem Behandlungsbedarf (Risikogruppe, aber keine Hospitalisierung, etwa 33 Prozent der Infizierten), die etwa 20 Minuten pro Konsultation pro Tag benötigen. Bei weiteren 13,8% der Infizierten wird Krankenhaus-Betreuung angesetzt, zu 100 fehlende Prozent sind infiziert aber asymptomatisch (ohne Behandlung).
Darüber hinaus benötigen bestimmte Patienten in \(R\) ambulante Betreuung, wenn sie in Krankenhaus/ICU-Behandlung waren (Patienten in der Nachsorge, etwa 66 Prozent der ehemals ICU-behandelten sowie alle übrigen Krankenhaus-Behandelten): 20 Minuten pro Konsultation alle 10 Tage für ehemalige ICU-Fälle und 15 Minuten alle 10 Tage für hospitalisierte Patienten.
Die notwendige Arztzeit pro Tag ergibt sich durch die summierten durchschnittlichen Konsultationsdauern. Diesen Wert haben wir durch eine mittlere Tagesarbeitszeit von 8 Stunden dividiert um zu einem Schätzwert für die täglich benötigte Versorgungsleistung in VZÄ zu gelangen.
Nicht berücksichtigt haben wir den Bedarf, der durch (verunsicherte) nicht-infizierte Patienten (in \(S\)) entsteht, die ärztliche Zeit in Anspruch nehmen (z.B. Anrufe bei leichten Erkältungssymptomen oder Durchführen von SARS-CoV-2-Tests, die sich als negativ herausstellen).
Aktuelle Daten
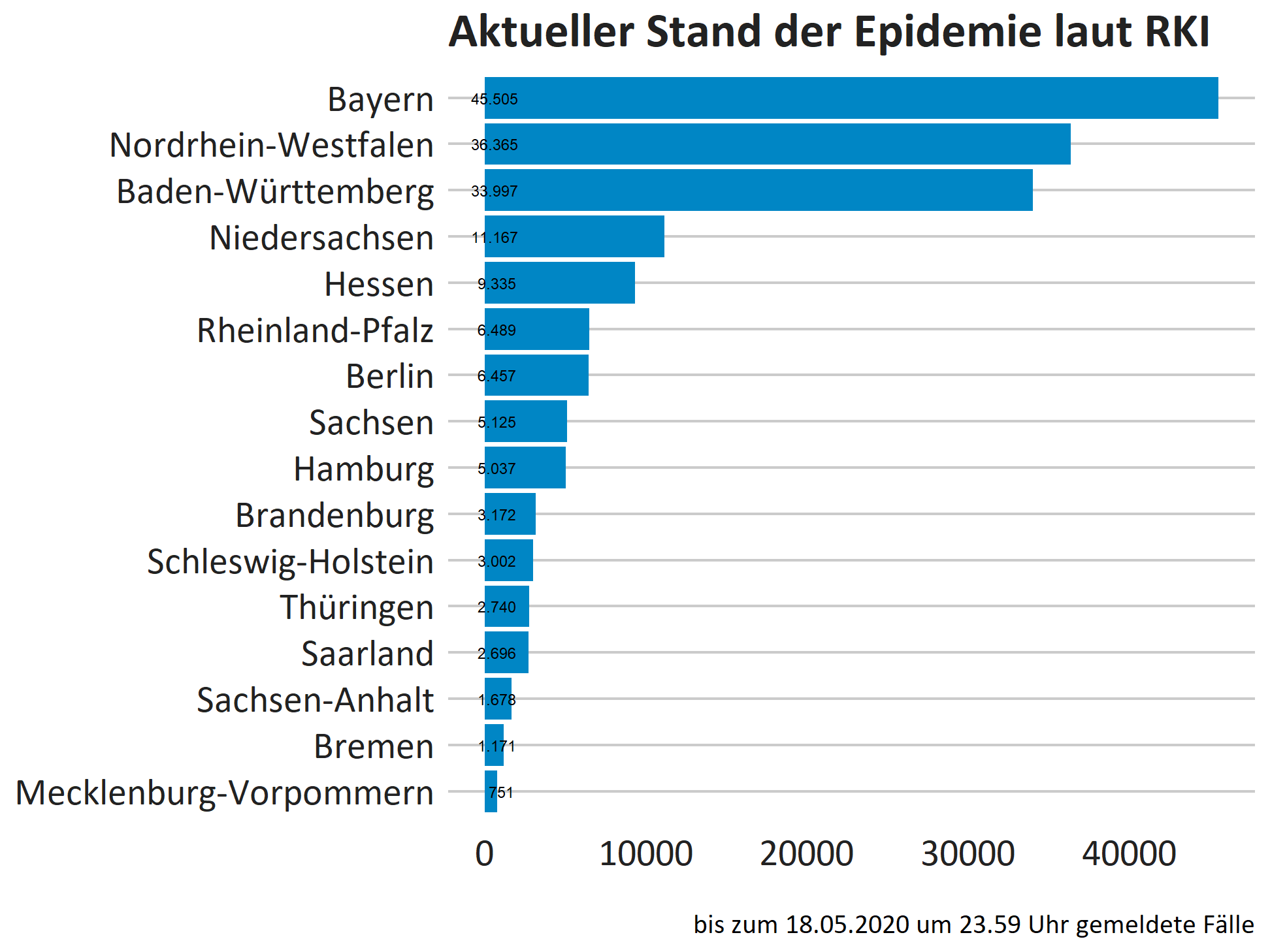
Die offiziellen deutschen Fallzahlen zu COVID-19-Erkrankungen werden vom RKI täglich aktualisiert und entsprechen den von den jeweiligen Gesundheitsämtern übermittelten Fällen. Dabei kommt es jedoch teilweise zu Meldeverzügen, so dass in diesen offiziellen Zahlen unterschieden werden muss zwischen Meldedatum und Übermittlungsdatum, insbesondere bei den Zahlen des letzten Tages: Die am aktuellen Tag vom RKI kommunizierte Zahl ist nicht endgültig. Weiterhin erschwerend kommt hinzu, dass generell Meldedatum und Infektionsereignis der Person nicht übereinstimmen. So hat die Infektion in der Regel bereits ein paar Tage vor der Meldung stattgefunden. Eine Meldung erfolgt erst nach bestätigtem Laborbefund.
Modellierung
Die Ergebnisse der Prognose hängen entscheidend von den Annahmen zur weiteren Inzidenzentwicklung ab. Hier wird das Szenario laufend an den aktuellen Erkenntnisstand angepasst.
Die aktuelle Modellierung basiert auf den bis zum 19.05.2020 um 23.59 Uhr beim RKI eingegangenen Meldungen. Insgesamt wurden 175.963 Fälle gemeldet.
Zeitlich variierende Reproduktionszahl \(R_t\)
Zur Berechnung von \(R_t\) auf den historischen Daten wurde das R-Paket “EpiEstim” verwendet (Thompson u. a. 2019; Cori u. a. 2013). Für 7-Tages-Fenster wird ein rollender Mittelwert der Reproduktionszahl mit einem bayesschen Schätzverfahren bestimmt. Da sich bei der Übermittlung der Infektionszahlen an das RKI Meldeverzüge ergeben, schließen wir die letzten 3 Tage aus der Berechnung von \(R_t\) aus (der Großteil der Meldeverzüge verteilt sich auf die letzten drei Tage). Ausgehend von diesem Stichtag berechnen wir einen linearen Trend von \(R_t\) innerhalb der letzten 5 Tage (wegen des rollenden Mittelwerts entspricht dies dem Trend der letzten 12 Tage). Dieser Trend wird in Szenario 1 und 2 fortgeschrieben bis zu einem Niveau von \(0{,}7\) (und danach konstant), falls er negativ ist, bei positivem Trend wird bis zu einer Reproduktionszahl von \(2{,}5\) fortgeschrieben. Szenario 3 beschreibt einen linearen Trend vom derzeitigen Niveau bis zum Niveau \(1{,}3\) innerhalb von 7 Tagen (und danach konstant).
Nähere Informationen zur Bestimmung der zeitlich variierenden Reproduktionszahl finden sich im Appendix.
SIR-Modell
Das zur Projektion verwendete SIR-Modell wird im Appendix beschrieben. In unserem Modell wird der Ansteckungsparameter \(\beta\) von den empirischen Werten \(R_0\) bzw. \(R_t\) abgeleitet, weiterhin wird der Infektionsdauerparameter \(\gamma\) konstant gesetzt als das Inverse der Infektionsdauer: \(\gamma=1/14\).
Andere Ansätze
Das hier verwendete SIR-Modell hat den Vorteil, dass es mit wenig Parametern und wenig strukturierten historischen Daten bereits angemessene Vorhersagen für die Zukunft erlaubt. Das Modell kann um weitere Patientengruppen (z.B. \(E\) für nicht-ansteckende Infizierte, \(D\) für Verstorbene, etc.) erweitert werden und außerdem können saisonale Effekte berücksichtigt werden. Dies bedeutet aber auch immer zusätzliche Parameter, die geschätzt oder belegt werden müssen.
Das RKI (Heiden und Buchholz 2020) verwendet ein SEIR-Modell, erweitert um unterschiedlich starke saisonale Effekte und unterschiedliche \(R_0\) in Abhängigkeit von potentiellen Erfolgen der Mitigationsmaßnahmen. Mögliche Projektionen für den stationären Behandlungsbedarf werden abgegeben, aber keine Auswirkungen auf den ambulanten Sektor benannt. Ebenso bleibt offen, was das wahrscheinlichste Szenario für die zukünftige Entwicklung ist.
Magal und Webb (2020) erweitern in ihrem technischen Paper das SIR-Modell, indem \(I\) in drei Gruppen aufgespaltet wird: asymptomatische Infizierte, sowie symptomatische identifizierte Infizierte und symptomatische unidentifizierte Infizierte. Für Deutschland prognostizieren sie auf Basis der gemeldeten Zahlen eine weiter exponentiell steigende Zahl von Infizierten, berücksichtigen aber keine Mitigationsmaßnahmen, da es in dieser Veröffentlichung vor allem um die Modell), die Parameterschätzungen basieren derzeit lediglich auf den historischen Daten aus China bzw. Fachveröffentlichungen und Prognosen für verschiedene Länder werden damit basierend auf den chinesischen Erfahrungen gemacht.
Ferguson u. a. (2020) sowie Walker u. a. (2020) benutzen als Alternative zu den differentialgleichungsbasierten Modellen Simulationsansätze (“agent-based”), bei denen stochastisch die Ansteckung von einzelnen Individuen über einen Zeitraum simuliert wird. Die Parameter verhalten sich bei diesen Ansätzen ähnlich wie im SIR-Modell und seinen Erweiterungen. Allerdings werden hier besser alltägliche Infektionssituationen (Haushalt, Schule, soziale Zusammenkünfte) abgebildet und modelliert. Insbesondere Ferguson u. a. (2020) heben stark die Bedeutung und den Einfluss von verschiedenen Mitigationsmaßnahmen hervor.
Limitationen
Eine Limitation fast aller Prognosemodelle ist die Dunkelziffer der (eventuell asymptomatischen) Infizierten, die nicht getestet und identifiziert werden, aber die Infektion weitergeben können. Eine Möglichkeit wäre, zusätzlich zu den Fallzahlen die Todesfälle \(D\) mit zu berücksichtigen und auch eine Patientengruppe \(U\) (nicht identifiziert, aber infiziert) zu modellieren, da die Todesfälle mit großer Sicherheit richtig identifiziert sind und eine konstante Todesrate bei Infektion angenommen werden kann (Lachmann 2020; Murray und IHME COVID-19 Health Service Utilization Forecasting Team 2020).
Sicherheit der Projektion
Um die Güte unserer Projektionen durch das Zi zu evaluieren, berechnen wir Modelle für historische Zeitpunkte und vergleichen deren Vorhersagen mit den tatsächlich nach diesem Zeitpunkt gemeldeten Zahlen. Folgende Aussagen lassen sich treffen:
- Auf Bundesebene gelingen die Vorhersagen bisher sehr gut;
- auf Bundeslandebene annehmbar gut für einen begrenzten Zeithorizont;
- auf Kreisebene sind die Fallzahlen zum Teil so gering und volatil, dass nicht in jedem Kreis verlässliche Vorhersagen getroffen werden können.
Generell sind Projektionen mit einem Horizont von mehr als vier Wochen nicht verlässlich zu erstellen, da das Ausbreitungsgeschehen stark durch gesellschaftliche Entwicklungen beeinflusst wird. Ebenso können Einzelereignisse, wie Großveranstaltungen oder Infektionsherde in Einrichtungen, auftreten und zu massiven Trendwenden (Zeitpunkt und Qualität) führen.
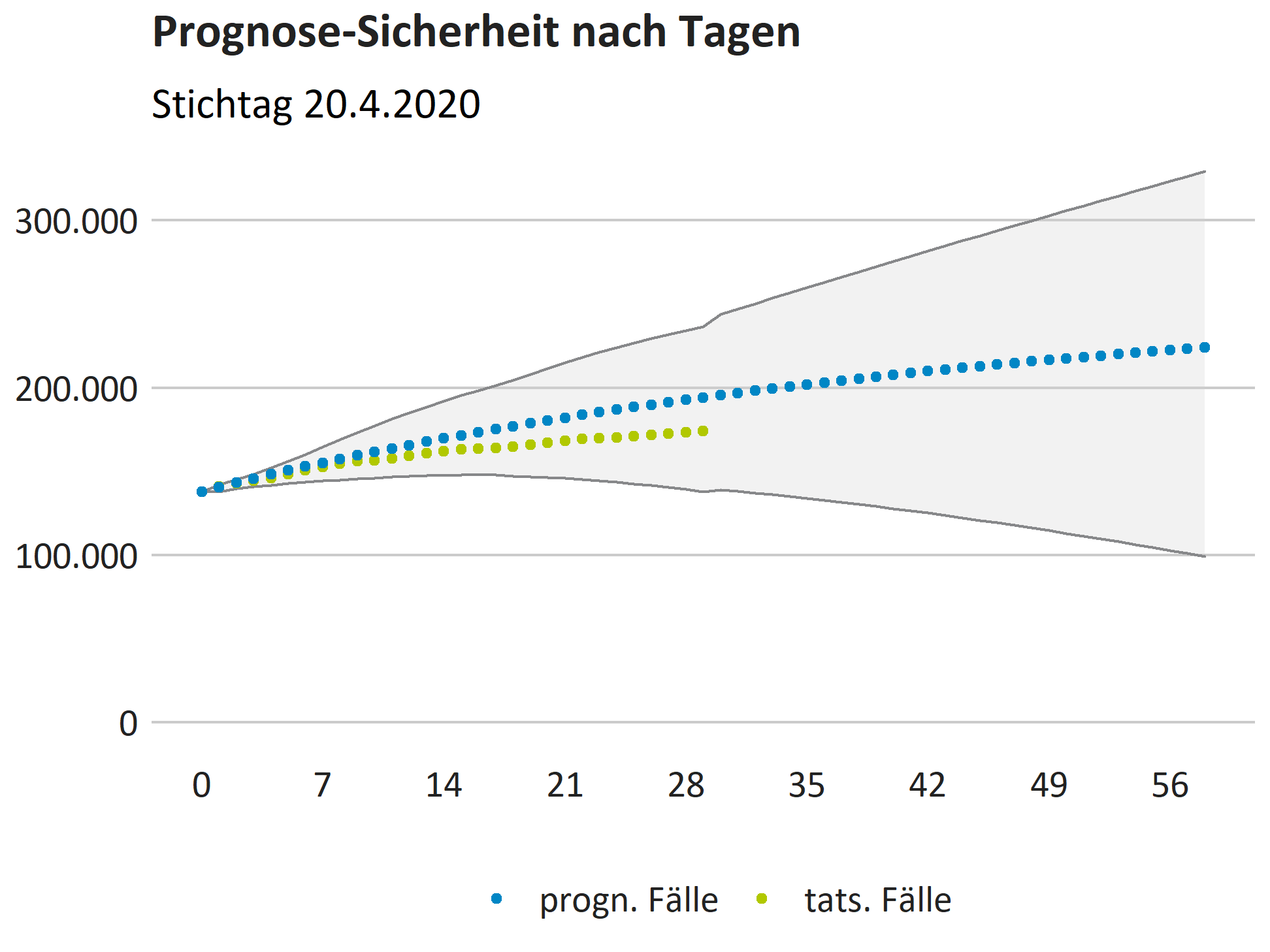
In der nachstehenden Grafik sind die prognostizierten Fallzahlen für Deutschland unseres Modells (“Trend lokal”) auf Basis des Stands der Daten vom Stichtag 20.4.2020 abgetragen, mit den tatsächlichen gemeldeten Fallzahlen seitdem und der weiteren Projektion. Die schattierte Fläche beschreibt ein 95%-Konfidenzintervall für die Projektion, das für die Zeit seit dem Stichtag auf Basis der prognostizierten und tatsächlichen Fallzahlen der Bundesländer berechnet und für den erweiterten Horizont linear fortgeschrieben wurde.
Zusammenfassung
So lange das Ansteckungsrisiko so groß ist, dass jede infizierte Person mehr als eine weitere Person ansteckt (mathematisch: \(R_t>1\)), gibt es ein exponentielles Wachstum der Infektionszahlen und innerhalb kurzer Zeit so viele Infizierte und Erkrankte, dass das Gesundheitssystem überlastet wird. Nur ein \(R_t<1\) kann dies verhindern oder diese Situation wieder beseitigen. Der internationale Vergleich zeigt, dass dies in Ländern wie Südkorea oder China gelungen ist, während in einigen Ländern noch exponentielles Wachstum vorliegt, aber sich zum Teil günstige Trends abzeichnen. Deustchland steht derzeit mit einer günstigen Reproduktionszahl \(<1\) da. Zukunftsprognosen sind schwierig, da nur begrenzt Aussagen über den Einfluss von Mitigationsmaßnahmen auf \(R_t\) bzw. das Ansteckungsrisiko quantifiziert werden können. Falls sich der aktuelle Trend fortsetzt und ein günstiges Reproduktionsniveau \(<1\) dauerhaft gehalten werden könnte, sind nach unseren Prognosen die ambulanten und stationären Ressourcen ausreichend. Es ist aber nicht auszuschließen, dass sich dieser Trend verändert, auf einem Niveau \(>1\) einfriert oder sogar umkehrt, wenn zu umfassende Lockerungen der Eindämmungsmaßnahmen beschlossen werden.
Anhang
A Berechnung des Ansteckungsrisikos: Die zeitlich variierende Reproduktionszahl
Im Unterschied zur Basisreproduktionszahl \(R_0\) berücksichtigt die zeitlich variierende Reproduktionszahl bzw. Nettoreproduktionszahl \(R_t\) auch die fortschreitende Immunisierung der Bevölkerung (nach durchstandener Infektion) und Kontrollmaßnahmen. \(R_t\) kann geschätzt werden als das Verhältnis von neuen Infektionen zu einem Zeitpunkt \(t\) und der Gesamtinfektiösität aller bereits infizierten Individuen zur Zeit \(t\) (Cori u. a. 2013). Das Maß für die Infektiösität eines Individuums ist die sogenannte Verteilung des seriellen Intervalls (“serial interval distribution”). Basierend auf der Literatur wird hier für diese Verteilung eine Gamma-Verteilung (\(\Gamma\)) mit Mittelwertsparameter \(5\) und Standardabweichungsparameter \(4\) angenommen (Du u. a. 2020; Nishiura u. a. 2020). Die Verteilung beschreibt den zufälligen Prozess, wann eine infizierte Person eine andere Person ansteckt, und deckt sich für die gewählten Parameter mit der Annahme, dass die Infektionsdauer in etwa 10 Tage beträgt, da das maßgebliche Gewicht der Veteilung auf den ersten 10 Tagen liegt. Weitere Modellannahmen sind, dass die Zahl der Neuinfizierten einer Poissonverteilung folgt und dass die Reproduktionszahl rollend konstant geschätzt wird für ein fixes Zeitintervall (hier: 7 Tage). Das ermöglicht, \(R_t\) mit bayesschen Verfahren zu schätzen, Details finden sich bei Thompson u. a. (2019).
B Prognose der Infektionszahlen: Das SIR-Modell
Beim SIR-Modell zur Modellierung von Infektionskrankheiten werden drei Gruppen unterschieden:
-
\(S\): “Susceptibles”, nicht infizierte Personen,
-
\(I\): “Infected”, (frisch) infizierte & ansteckende Personen,
-
\(R\): “Removed”, nicht mehr ansteckende Personen (genesen oder gestorben).
Folgende wichtige Annahmen beinhaltet das Modell:
-
die Reihenfolge der Zustände ist \(S\rightarrow I \rightarrow R\), das heißt jede Person kann nur einmal erkranken und genest/stirbt letztendlich,
-
die Bevölkerungszahl \(N\) wird für den Modellierungshorizont als konstant angenommen (\(S+I+R=N\), Geburten werden nicht berücksichtigt),
-
Personen in \(I\) sind mit konstanter Rate \(\beta\) ansteckend,
-
Personen in \(I\) verlassen diesen Zustand mit konstanter Rate \(\gamma\) (genesen oder versterben),
-
Personen in den drei Gruppen interagieren auf gleiche Weise miteinander.
Unter diesen Annahmen kann die zeitliche Entwicklung der Infektionsausbreitung mit einem Differentialgleichungssystem modelliert werden:
\[\frac{dS}{dt} = -\frac{\beta}{N} \cdot I \cdot S,\] \[\frac{dI}{dt} = \frac{\beta}{N} \cdot I \cdot S - \gamma \cdot I,\] \[\frac{dR}{dt} = \gamma \cdot I.\]Weiterhin gilt, dass die Ansteckungsrate \(R_0\) aus den Parametern des Differentialgleichungssystems geschätzt werden kann:
\[R_0 = \frac{\beta}{\gamma}.\]Umgekehrt kann auch aus bekanntem \(R_0\) und fixem \(\gamma\) der Parameter \(\beta\) geschätzt werden.
Mit den ermittelten Parametern können Prognosen für die zukünftige Verteilung der drei Gruppen abgegeben werden. Ebenso lässt sich bei Konstanthaltung von \(\gamma\) mit Variierung von \(R_0\) bzw. \(\beta\) der zukünftige Einfluss von ansteckungsverhindernden Maßnahmen modellieren.
Literatur
AKSAMENTOV, Ivan u. a., 2020. COVID-10 Scenarios [online]. 2020. Verfügbar unter: https://neherlab.org/covid19/
CORI, Anne u. a., 2013. A New Framework and Software to Estimate Time-Varying Reproduction Numbers During Epidemics. American Journal of Epidemiology. September 2013. Bd. 178, Nr. 9, S. 1505–1512. DOI 10.1093/aje/kwt133
DGEPI, 2020. *Stellungnahme der Deutschen Gesellschaft für Epidemiologie (DGEpi) zur Verbreitung des neuen Coronavirus (SARS-CoV-2). 2020. Download
DU, Zhanwei u. a., 2020. The serial interval of COVID-19 from publicly reported confirmed cases. medRxiv. 2020. DOI 10.1101/2020.02.19.20025452
FERGUSON, Neil M u. a., 2020. Impact of non-pharmaceutical interventions (NPIs) to reduce COVID-19 mortality and healthcare demand.. 2020. DOI 10.25561/77482
GRASSELLI, Giacomo u. a., 2020. Critical Care Utilization for the COVID-19 Outbreak in Lombardy, Italy: Early Experience and Forecast During an Emergency Response. JAMA. März 2020. DOI 10.1001/jama.2020.4031
GUAN, Wei-jie u. a., 2020. Clinical Characteristics of Coronavirus Disease 2019 in China. New England Journal of Medicine. 2020. DOI 10.1056/NEJMoa2002032
HEIDEN, Matthias an der und Udo BUCHHOLZ, 2020. Modellierung von Beispielszenarien der SARS-CoV-2-Epidemie 2020 in Deutschland.. 2020. DOI 10.25646/6571.2
KERMACK, William O und Anderson G MCKENDRICK, 1991. Contributions to the mathematical theory of epidemics–I. 1927. Bulletin of mathematical biology. 1991. Bd. 53, Nr. 1-2, S. 33—55. DOI 10.1007/bf02464423
LACHMANN, Alexander, 2020. Correcting under-reported COVID-19 case numbers. medRxiv. 2020. DOI 10.1101/2020.03.14.20036178
MAGAL, Pierre und Glenn WEBB, 2020. Predicting the number of reported and unreported cases for the COVID-19 epidemic in South Korea, Italy, France and Germany. medRxiv. 2020. DOI 10.1101/2020.03.21.20040154
MURRAY, Christopher JL und IHME COVID-19 HEALTH SERVICE UTILIZATION FORECASTING TEAM, 2020. Forecasting COVID-19 impact on hospital bed-days, ICU-days, ventilator-days and deaths by US state in the next 4 months. medRxiv. 2020. DOI 10.1101/2020.03.27.20043752
NISHIURA, Hiroshi u. a., 2020. Serial interval of novel coronavirus (COVID-19) infections. International Journal of Infectious Diseases. 2020. DOI 10.1016/j.ijid.2020.02.060
THE NCPERE TEAM, 2020. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China. CCDC Weekly. 2020. Bd. 2, Nr. 8, S. 113–122. DOI 10.3760/cma.j.issn.0254-6450.2020.02.003
THOMPSON, R. N. u. a., 2019. Improved inference of time-varying reproduction numbers during infectious disease outbreaks. Epidemics. 2019. Bd. 29, S. 100356. DOI https://doi.org/10.1016/j.epidem.2019.100356
VERITY, Robert u. a., 2020. Estimates of the severity of coronavirus disease 2019: a model-based analysis. The Lancet infectious diseases. 2020. DOI 10.1016/S1473-3099(20)30243-7
WALKER, Patrick GT u. a., 2020. The Global Impact of COVID-19 and Strategies for Mitigation and Suppression.. 2020. DOI 10.25561/77482
WHO TEAM, 2020. Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) [online]. 2020. Verfügbar unter: https://www.who.int/publications-detail/report-of-the-who-china-joint-mission-on-coronavirus-disease-2019-(covid-19)
